腹泻疾病除在儿童和幼小动物上有着极高的死亡率外,还造成机体肠道屏障功能受损继而引发肠道炎症,最终导致生长迟缓。肠道菌群与腹泻疾病密切相关,一些特定的细菌菌株已被证明具有抗腹泻作用,然而其抗腹泻机制尚未阐明。
2023年6月6日,华中农业大学陶诗煜副研究员团队在npj Biofilms and Microbiomes(IF=9.2)发表题为“Limosilactobacillus mucosae-derived extracellular vesicles modulates macrophage phenotype and orchestrates gut homeostasis in a diarrheal piglet model”的研究论文。该团队以新生仔猪、无菌(GF)小鼠和无特定病原体(SPF)小鼠为动物模型,结合多组学、粪便微生物移植(FMT)、产肠毒素大肠杆菌K88 (ETEC K88)诱导的肠道炎症损伤模型以及黏膜乳杆菌(L. mucosae)及其衍生的胞外囊泡(EVs)的干预技术,系统地研究了新生腹泻仔猪肠道菌群特征,揭示了肠道菌群与腹泻疾病之间的关系,阐明了健康仔猪粪便来源的乳杆菌抗腹泻的潜在机制。(麦特绘谱提供Q300全定量代谢组检测分析服务)

本研究实验设计
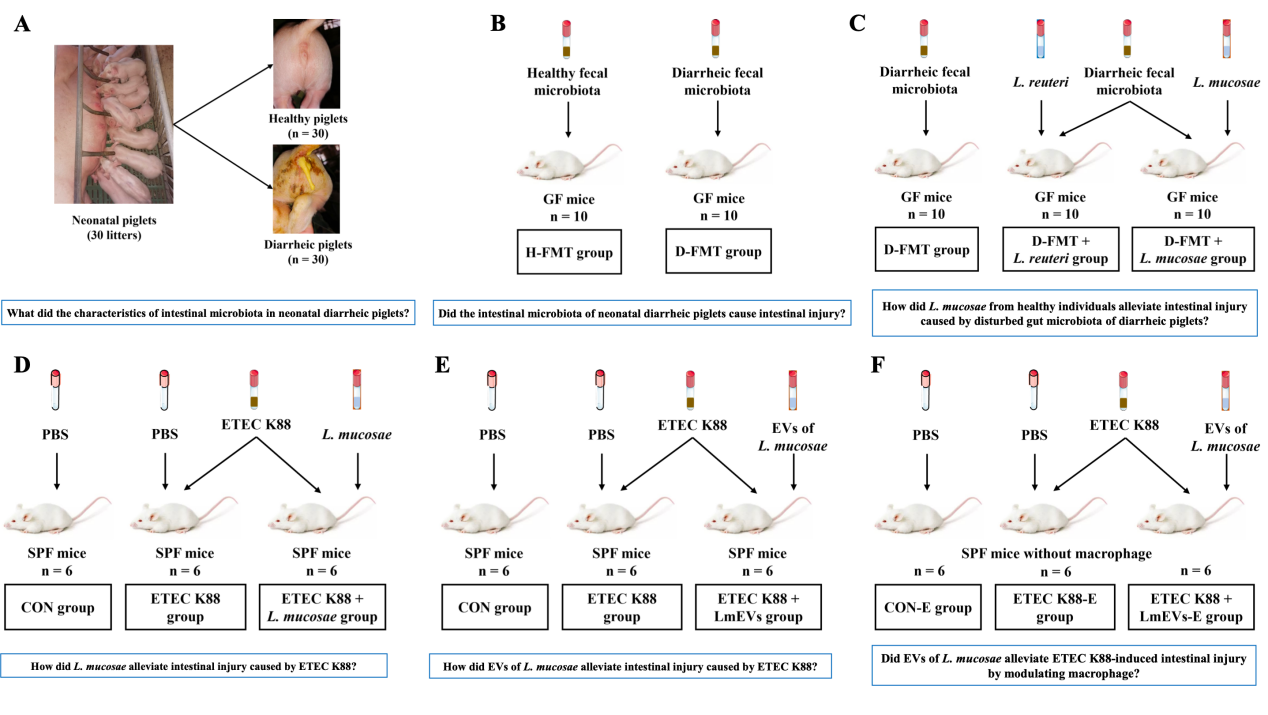
图1. 本研究试验设计
研究结果
1. 健康仔猪和腹泻仔猪肠道菌群存在差异
本研究首先收集了新生健康仔猪和腹泻仔猪的粪便样品各30例进行宏基因组测序。生物信息学分析发现腹泻和健康仔猪的微生物区系结构之间存在着巨大的差异,腹泻仔猪肠道微生物的物种多样性升高但丰富度降低。两组仔猪的肠道微生物在种水平上存在巨大差异,其中有四个乳杆菌种显著富集于健康仔猪组。随机森林分析表明,罗伊式乳杆菌(L. reuteri)和黏膜乳杆菌(L. mucosae)是区分健康仔猪和腹泻仔猪的关键菌种,提示它们可能在对抗腹泻疾病中起着重要的介导作用。KEGG功能分析显示,新生腹泻仔猪的LPS生物合成通路显著高于健康仔猪且粪便中的LPS含量也明显高于健康仔猪。
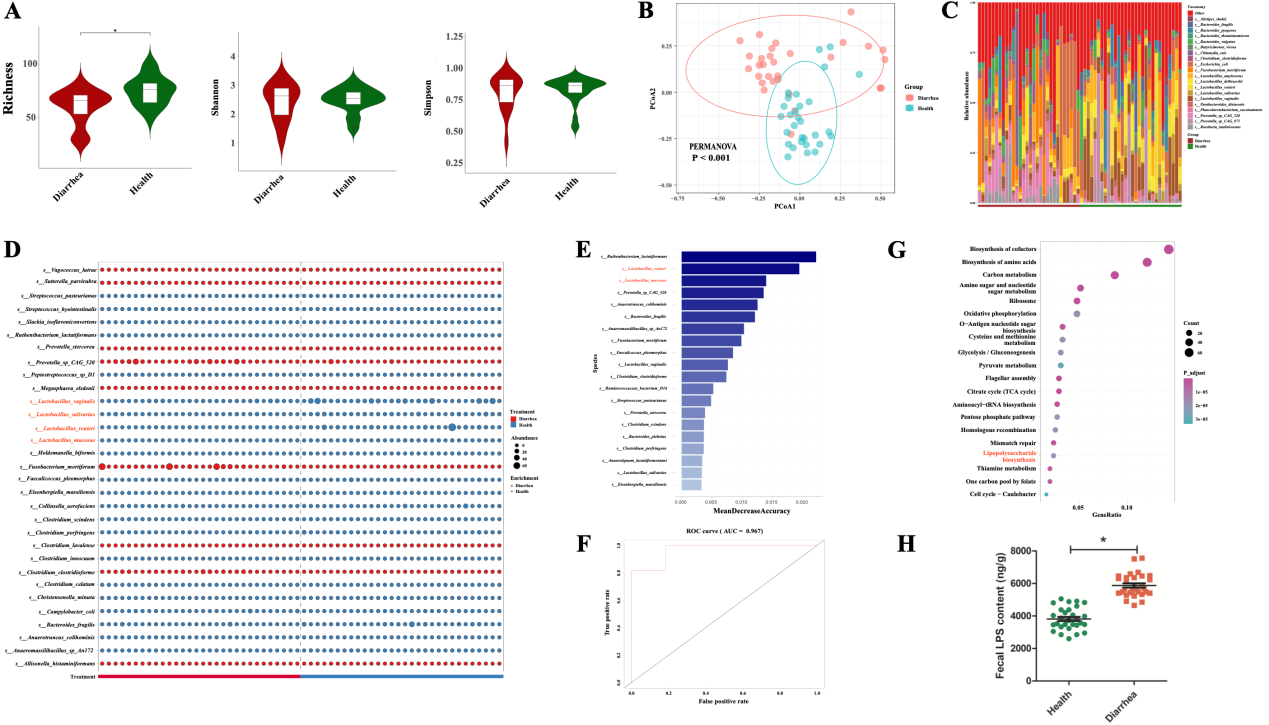
图2. 新生腹泻仔猪与健康仔猪种水平肠道菌群特征
2. 腹泻仔猪粪便菌群移植导致GF小鼠生长迟缓、全身炎症和肠道炎症损伤
本研究将新生仔猪的粪便微生物群移植到GF小鼠,结果发现移植腹泻仔猪粪便微生物群的GF小鼠生长发育迟缓,并伴有严重的全身炎症反应。与供体结果一致,健康仔猪和腹泻仔猪微生物受体GF小鼠之间的肠道微生物群区系结构也存在明显差异。值得注意的是,一些肠道微生物群相关的功能途径从供体猪转移到受体小鼠身上,如LPS的生物合成。另外腹泻仔猪微生物受体小鼠血清中的LPS浓度显著高于健康仔猪微生物受体小鼠的浓度。代谢组学结果显示,两组受体小鼠的粪便代谢物存在显著差异。一些具有抗炎作用的代谢物(3,4-二羟基苯丙酸、高香草酸和苯乳酸在健康仔猪微生物受体小鼠中富集,而促炎代谢物(吡啶甲酸)则在腹泻仔猪微生物受体小鼠中富集。
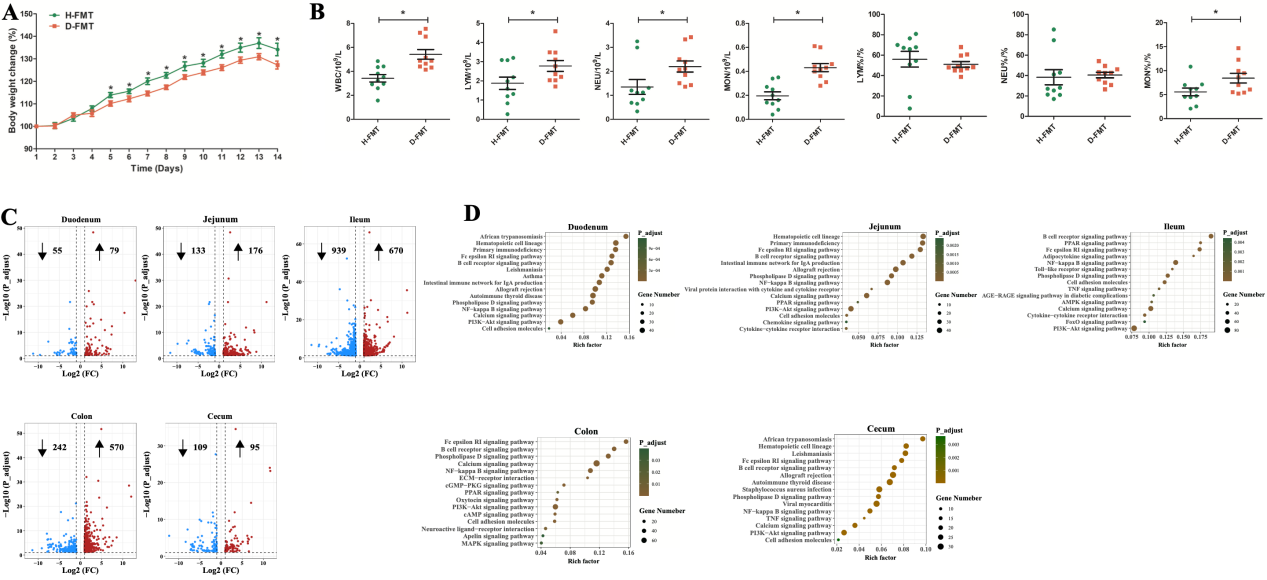
图3. H-FMT GF小鼠与D-FMT GF小鼠的生长、全身炎症和肠道转录组特征的评估
另外,腹泻仔猪肠道微生物群移植后对受体GF小鼠肠道发育也有巨大影响,具体表现为各肠段组织的基因表达谱发生显著变化。RNA-seq结果显示,5个肠段的差异基因主要富集在与炎症和免疫相关的信号通路上,如NF-κB和PI3K-AKT。NFκB和AKT是介导炎症反应的重要蛋白分子,磷酸化后激活其生物学功能。WB结果显示,NF-κB和AKT的磷酸化在腹泻受体小鼠的肠道中均升高,而紧密连接蛋白表达水平降低。同时促炎细胞因子水平在腹泻仔猪微生物受体小鼠肠道组织中也同样升高。以上结果表明,腹泻个体肠道菌群紊乱通过激活炎症信号通路,损害肠道屏障功能,引发机体肠道炎症反应。
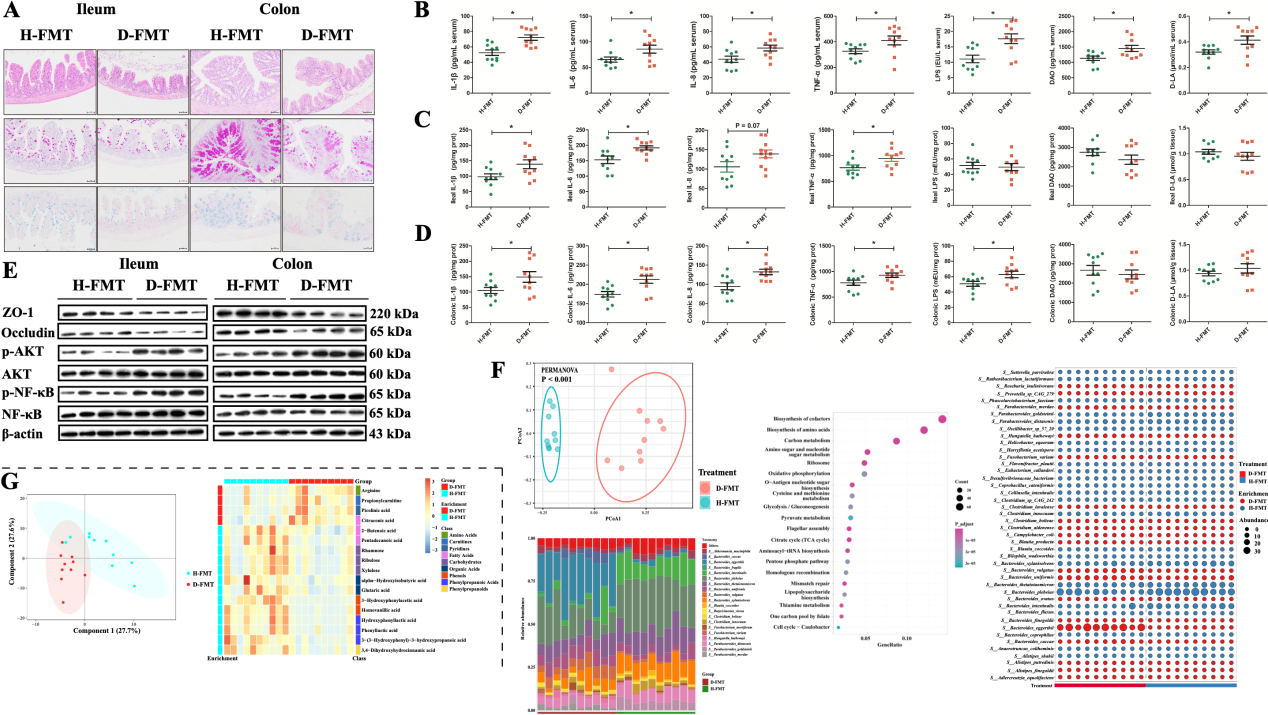
图4. H-FMT GF小鼠与D-FMT GF小鼠的肠道屏障、炎症反应和微环境特征
3. L. mucosae通过抑制炎症反应和调节肠道菌群缓解GF受体小鼠腹泻症状
上述宏基因组结果提示L. reuteri和L. mucosae是区分健康和腹泻新生仔猪的关键菌种。为了验证它们是否具有潜在的抗腹泻功效,研究团队从健康新生仔猪粪便样本中分离出L. reuteri和L. mucosae菌株后进行后续干预实验。结果显示,只有L. mucosae能够显著缓解由腹泻仔猪粪便微生物群所致的GF小鼠生长迟缓和肠道炎症损伤。16S rRNA基因测序结果发现,经L. mucosae干预后腹泻仔猪微生物受体小鼠肠道菌群结构发生变化,乳酸菌属在L. mucosae干预组显著富集。
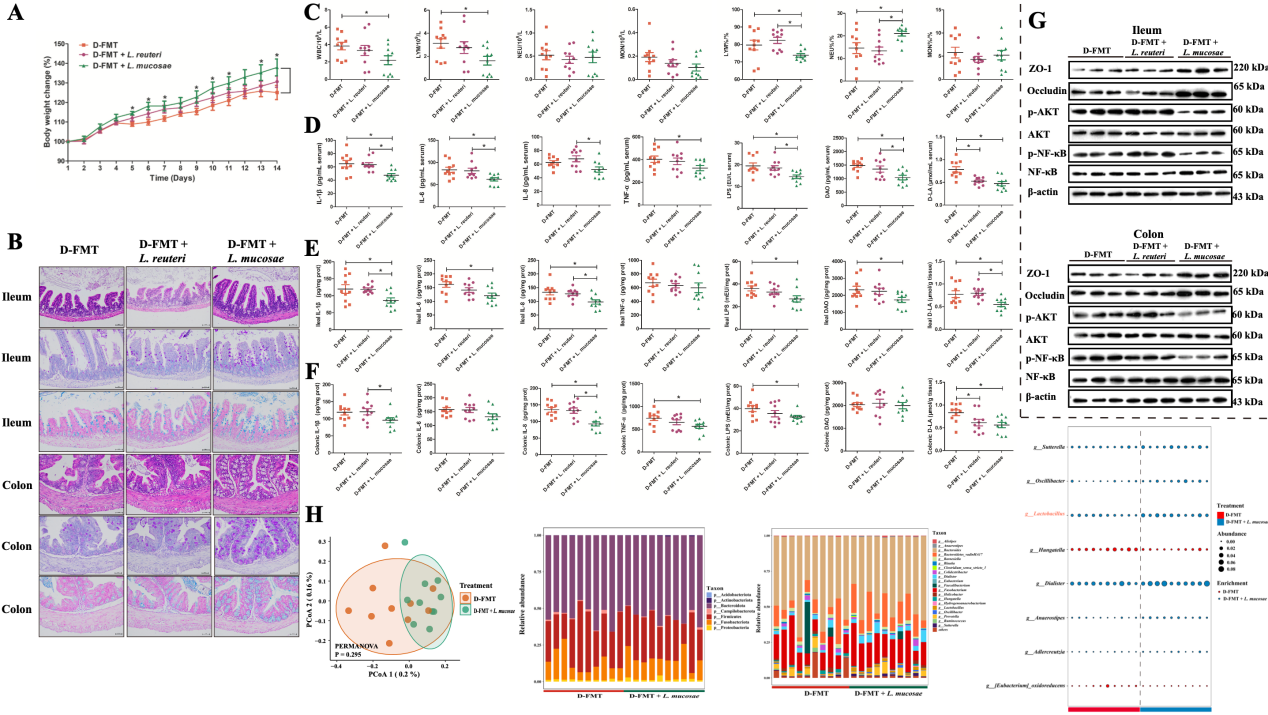
图5. L. reuteri和L. mucosae对腹泻仔猪粪便菌群所致肠道损伤的缓解作用
4. L. mucosae通过抑制炎症反应和调节肠道菌群缓解ETEC K88攻毒小鼠腹泻症状
本研究还探讨了L. mucosae对ETEC K88攻毒SPF小鼠后的影响。数据显示L. mucosae通过抑制LPS的合成、NF-κB和AKT的磷酸化表达及增加乳酸菌丰度,有效缓解由ETEC K88攻毒引起的炎症反应和肠道损伤。
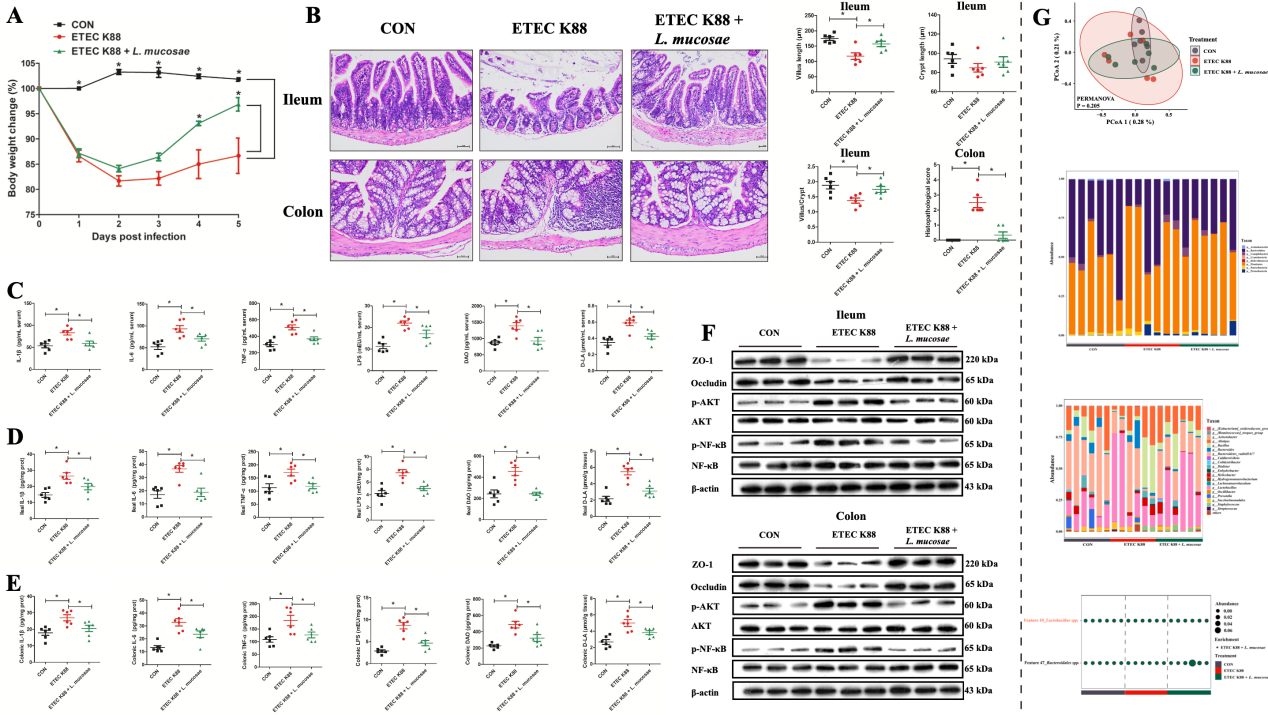
图6. L. mucosae对ETEC K88攻毒小鼠肠道损伤的缓解作用
5. L. mucosae衍生的EVs (LmEVs)介导巨噬细胞分型缓解ETEC K88攻毒小鼠腹泻症状
微生物对宿主生理功能的调节除了与宿主直接相互作用外,还可以通过分泌活性物质来介导。细菌分泌的胞外囊泡可以通过运输和递送调节宿主信号通路和细胞过程的效应分子来影响宿主的健康。本研究成功分离并鉴定了LmEVs进行后续的干预试验。结果发现,LmEVs能够缓解腹泻症状且比亲本细菌更佳。
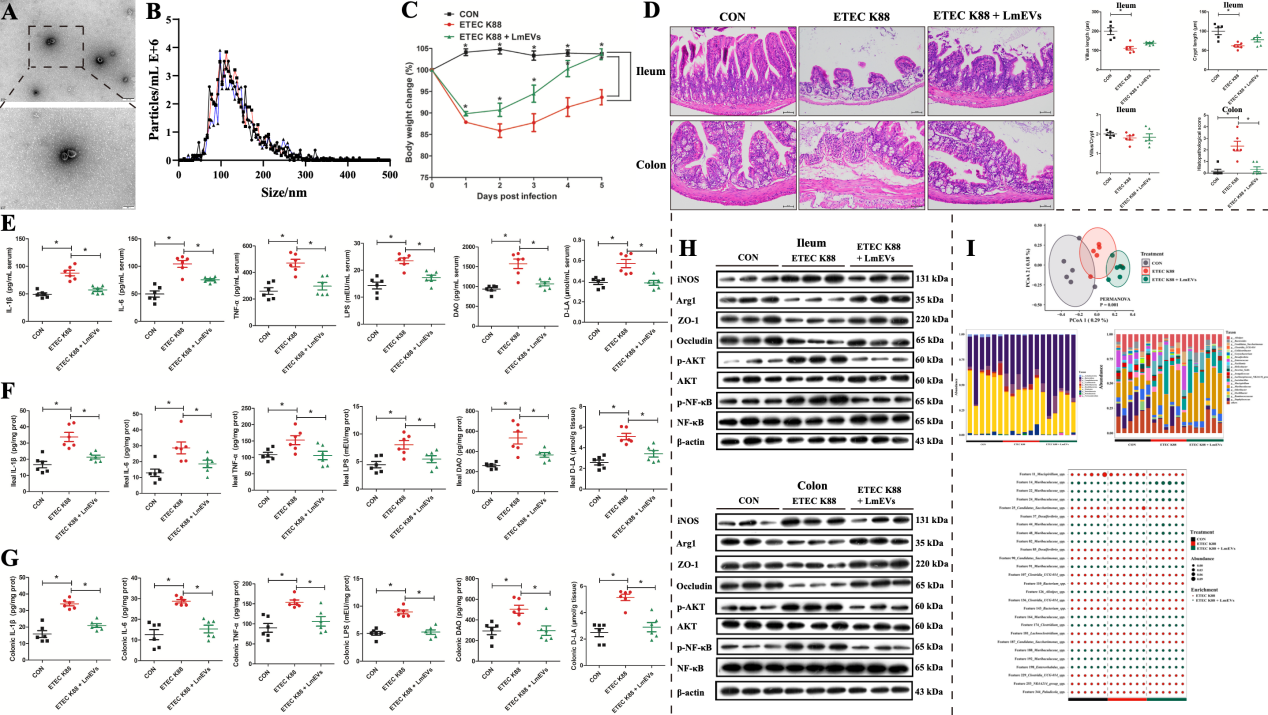
图7. LmEVs对ETEC K88攻毒小鼠肠道损伤的缓解作用
6. 巨噬细胞是LmEVs缓解ETEC K88攻毒小鼠腹泻症状所必需的
巨噬细胞作为启动和调节炎症反应的核心细胞,可以产生多种细胞因子,促进肠道上皮细胞增殖,调节上皮屏障的完整性,在维持肠道稳态中发挥重要作用。本研究结果显示,LmEVs干预能激活M2巨噬细胞极化,抑制炎症调节蛋白(NF-κB和AKT)的表达。然而,在巨噬细胞消除小鼠模型中,LmEVs丧失了缓解腹泻症状的能力。以上结果表明,LmEVs通过调节巨噬细胞表型缓解腹泻症状。
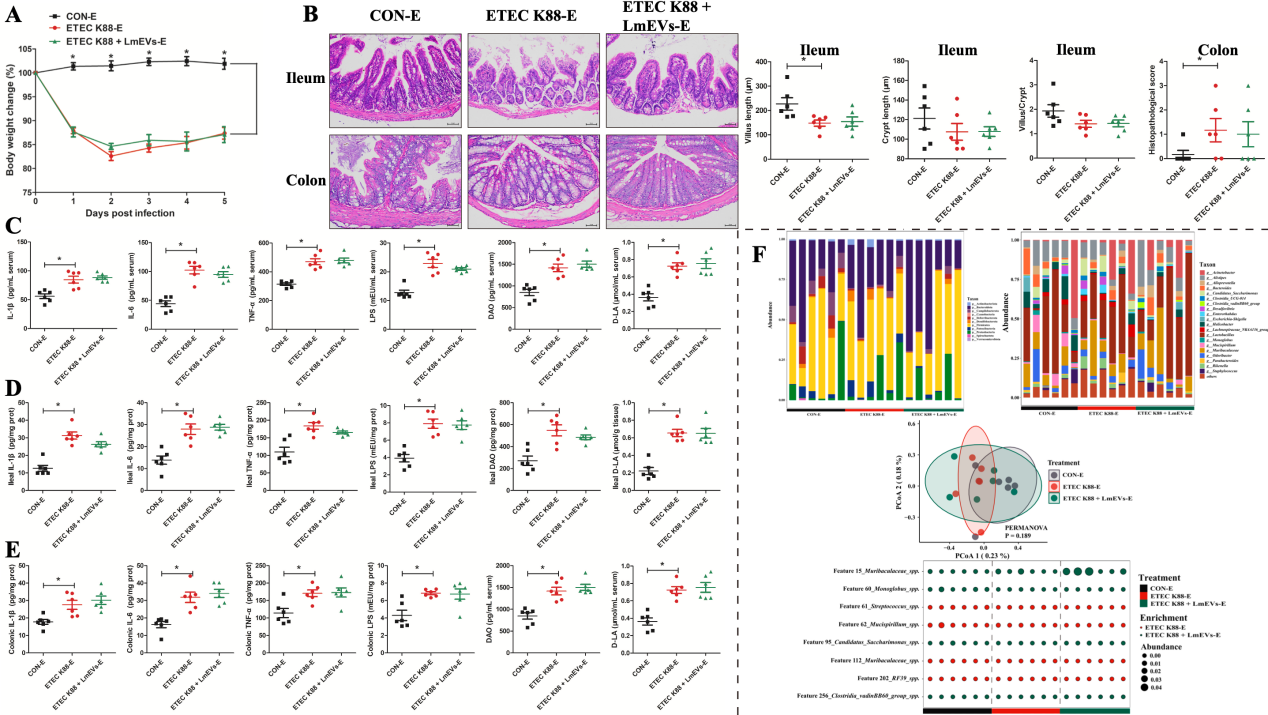
图8. 巨噬细胞清除对LmEVs在缓解ETEC k88攻毒小鼠肠道损伤中的影响
小结
本研究发现腹泻仔猪中肠道菌群紊乱,主要特征是乳酸菌丰度降低、大肠杆菌丰度增加和LPS生物合成通路增加,其中L. mucosae和L. reuteri是区分仔猪健康和腹泻的关键细菌;腹泻仔猪微生物群移植GF小鼠后导致其生长迟缓、肠道炎症损伤、肠道菌群及代谢紊乱;机制上,腹泻个体的肠道菌群通过激活LPS促炎信号通路,导致肠道屏障功能受损,过量的LPS从肠腔转移到血液循环中,诱发全身性的炎症反应,最终导致生长迟缓;从健康仔猪粪便中分离的L. mucosae可缓解小鼠腹泻症状;L. mucosae衍生的EVs调节巨噬细胞表型缓解ETEC K88攻毒小鼠的腹泻症状。
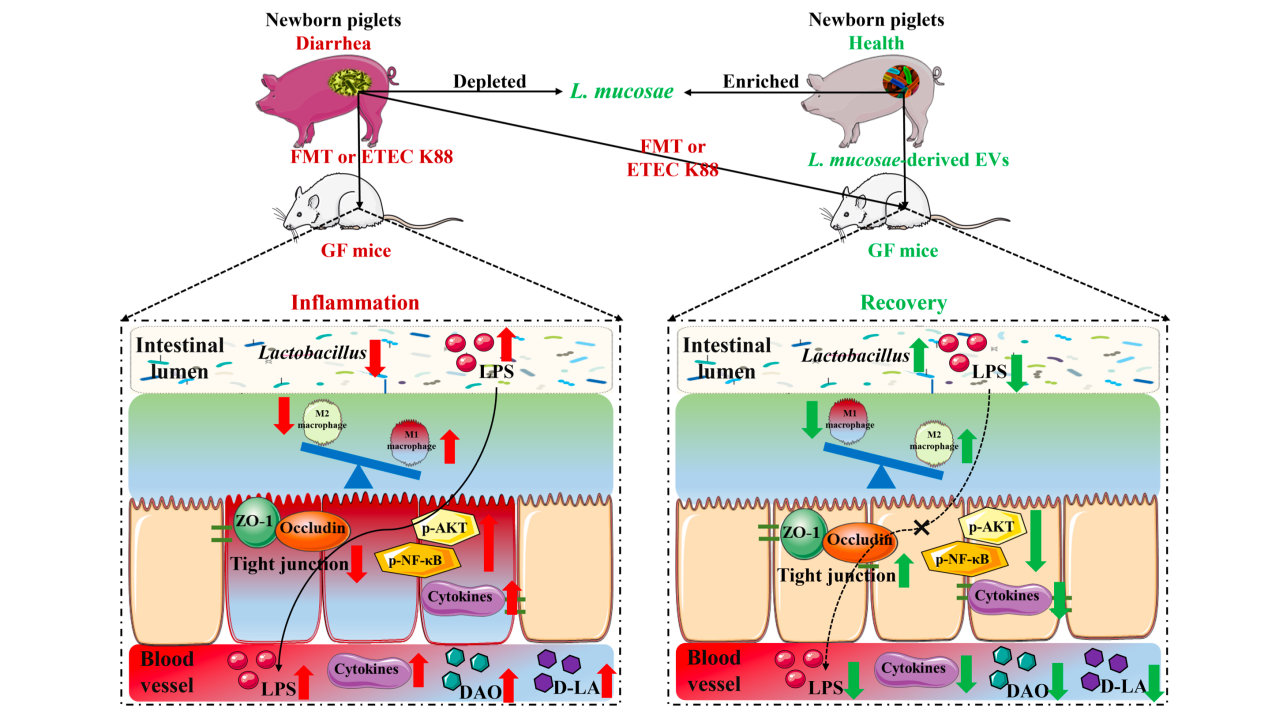
图9. 本研究结果总结图
原文文献
Li, J., Feng, S., Wang, Z. et al. Limosilactobacillus mucosae-derived extracellular vesicles modulates macrophage phenotype and orchestrates gut homeostasis in a diarrheal piglet model. npj Biofilms Microbiomes 9, 33 (2023). https://doi.org/10.1038/s41522-023-00403-6
请扫描二维码阅读原文

供稿:陶诗煜副研究员团队
绘谱帮你测
上述研究由麦特绘谱提供Q300全定量代谢组检测技术研究肠道菌群及代谢物介导腹泻的发生机制,并提出潜在的干预治疗手段。目前,Q300技术已协助客户发表70余篇SCI文章,平均IF>10,成果涵盖肿瘤/癌症、代谢性疾病、免疫疾病、神经系统性疾病、衰老、环境毒理学、中医中药等研究领域。
往期回顾
1. 客户案例 | 又双叒是UDCA!胆汁酸谱技术助力中国农业大学团队在猪肠道研究中取得新突破!
2. Microbiome | 中国农大科研团队发现犊牛肠道健康重要“标志物”
3. Science&Nature领衔 | 麦特绘谱2023上半年项目文章迎来“质”的飞跃
4. 客户案例 | Nature主刊:新机制!肠道菌群如何通过改变饮食成分来影响宿主免疫
5. 客户案例 | IF 12:利用微流控芯片分离新冠幸存者血浆sEVs进行代谢组学研究

