时常会考虑到一个问题:人的存在,是为了大脑,还是心脏?虽说项目中经常研究靶点问题,可是面对复杂细胞构造,还是觉得其中机理过于神奇。如果把问题简单看,细胞的核心,应该在细胞核之中。那么细胞的存在,是否又是为了保持相对完整的基因组呢?感觉自己又回到了上学时代,每次看到氨基酸对应的密码子都觉得太神奇,就会想到《创世纪的第八天》中提到的DNA反向双螺旋结构的发现过程——反向、双螺旋、碱基互补,觉得很美!如果有这样一个模型,我想应该摆放在办公桌上,时而让人思考一些基本问题。
DNA常驻核中,时而沉睡,时而清醒;时而松弛,时而紧张。最近在做过一个POLQ相关的TMEJ实验,我们合成了一个线性的DNA,包括启动子+报告蛋白+转录终止子,结果显示转染后2小时,就有很多蛋白已经被编码出来。这表明细胞核中的转录、mRNA出核、核糖体翻译蛋白的过程,可以很快,效率很高,这和《三体》中的世界很像,也可能像分子反应一样,即有合适的原料(蛋白,mRNA, DNA)、合适的条件(时间、空间、结构),就会产生一定的产物(转录、翻译、复制)。能进入细胞核的成员,是否都是关键成员?常驻核中的成员,是否不易靶向?本文简要介绍下EZH2和EED相关药物研发进展,并提供相应解决方案。
支原体细胞中核酸和蛋白的虚拟结构1
EZH2,enhancer of zeste homolog 2,是Polycomb group (PcG) protein家族成员,PRC2复合物的一个催化亚基,从植物、到蝇虫到人类都高度保守,可通过甲基化组蛋白H3第27位赖氨酸来影响DNA的转录水平,抑制包括200种以上的抑癌基因的表达,主要有HOXC8, HOXA9, MYT1, CDKN2A 和retinoic acid target genes等等。EZH2蛋白常在乳腺癌、前列腺癌、膀胱癌中高表达2。PRC2全称polycomb repressive complex 2,家族中还有PRC1和PhoRC,主要负责催化H3K27的甲基化(H3K27me1, H3K27me2, and H3K27me3)。
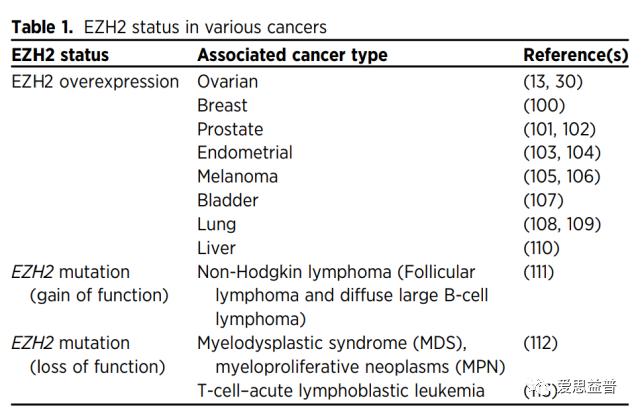 EZH2 status in various cancers3
EZH2 status in various cancers3
现在再看这种复合物的功能,觉得很神奇,大家以团队协作的方法,发挥着全新的功能。单独看蛋白自身的结构,功能域并不多。这个不像胞质中蛋白间简单的信号转导,如蛋白互作后容易快速发生磷酸化和去磷酸化,需要将信号快速传递下去,最终反馈到细胞核中。在细胞核中,更容易接触到遗传信息,调控机制也比较复杂。在肩负复制、传递遗传物质的职责外,还需要考虑细胞的应激调控,DNA的活化和去活化的职能部门,是相当辛苦的。PRC2的复合物,由主要5个成员组成(有报道称至少需要4个成员4),有催化亚基EZH2 (enhancer of zeste homolog 2),调节亚基EED(embryonic ectoderm development)和SUZ12(suppressor of zeste 12),组蛋白结合蛋白RbAp46/48 (also known as RBBP7/4),还有结合DNA启动子并抑制其转录的锌指蛋白AEBP2(Adipocyte Enhancer-Binding Protein 2),也有报道显示EED可结合甲基化后的H3K27,根据蛋白自身结构域的特点,大致可以猜想各个蛋白间的配合过程和PRC2对DNA活化的抑制作用。
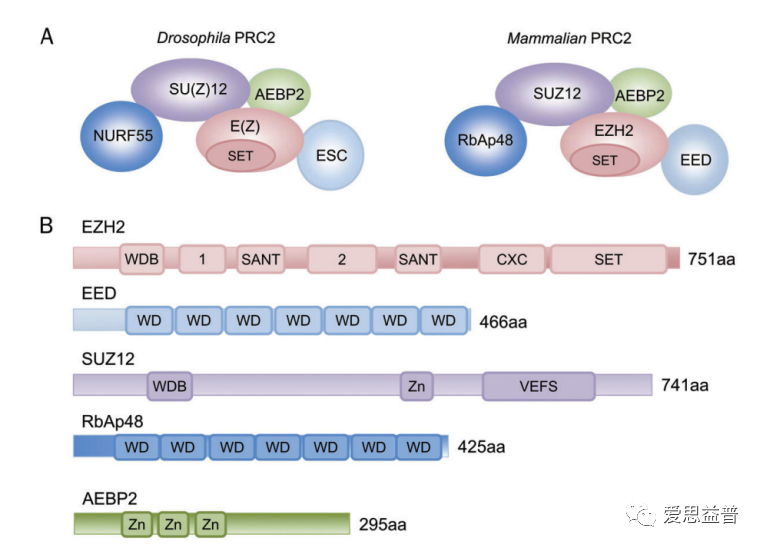 Possible architecture of the PRC2 complex2
Possible architecture of the PRC2 complex2
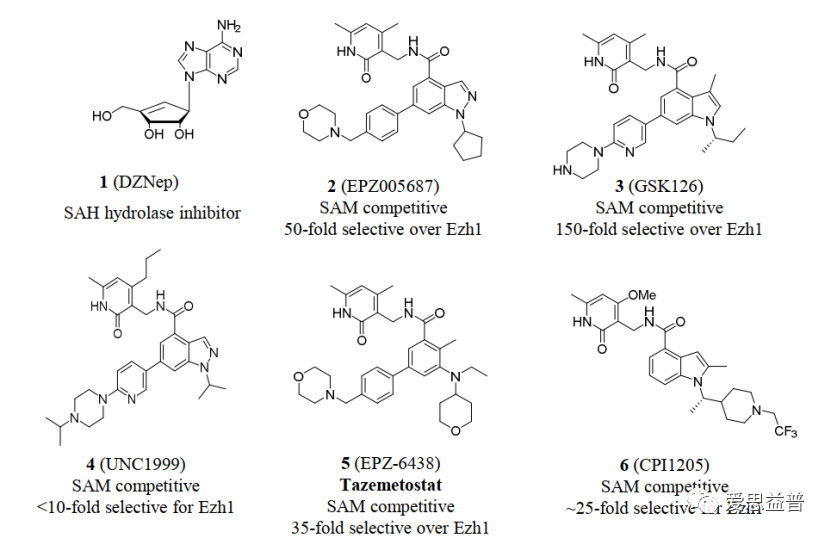
Selected PRC2 inhibitors5
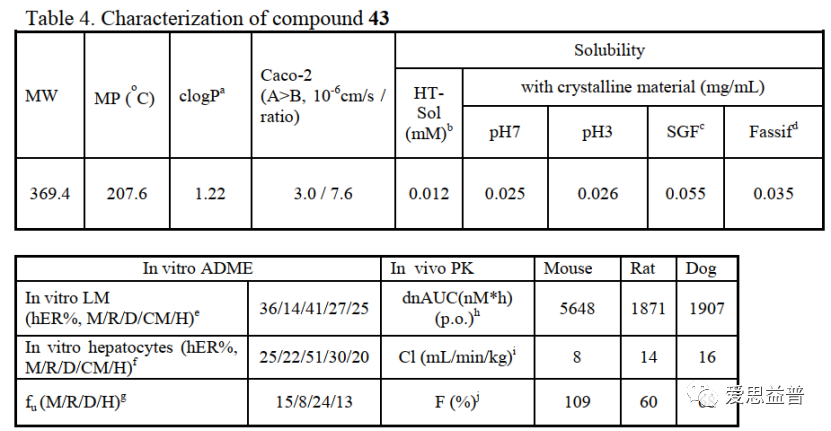
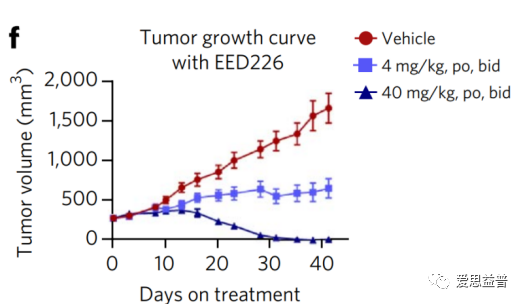
其中EED蛋白有报道显示该蛋白可结合三甲基化的组蛋白,抑制DNA的活化,关键位点突变后会使PRC2复合体失去对组蛋白的甲基化能力,如此便引入了一个可变构调节PRC2复合物活性的可能性。6关于PRC2和EZH2的研究及药物研发工作已开展多年7,8,也发现了很多高活性的分子,体现很好的效果,如DZNep,EPZ005687,GSK126,UNC1999,,EI1,GSK343,GSK926,EPZ011989,ZLD10A,,CPI-360和CPI-169等3,还有处于临床阶段的PF-06821497(NCT03460977)CPI-1205 (Lirametostat,NCT02395601)和DS-3201b(Valemetostat)9,海和生物的HH285310,信诺维的XNW5004、恒瑞的SHR2554等等,还有去年FDA批准上市的EPZ-6438 (Tazemetostat)4,足以展示该靶点和通路成药性方面的优势。只是临床中也发现突变耐药的情况,如Y111D,A677G,Y641F/N,Y726F等等11-13,IGF-1R, PI3K和 MAPK等通路的活化,也会拮抗药物的抑制作用,科学家们也在这条通路上仍在寻找新的靶点。看到2022年AACR的摘要中报道了HH2853与tazemetostat头对头相比的体内、体外的活性数据,显示对EZH1/2有较高的的抑制活性,并且对耐药突变有效果,目前处在临床招募阶段,期待会议后能看到更有优质的数据。2013年有团队报道破坏EZH2和EED(embryonic ectoderm development)之间的相互作用,可抑制依赖EZH2介导的H3K27的甲基化,进而抑制癌细胞的增殖14,在某种程度上提供了一些肿瘤选择性的抑制,避免了直接抑制EZH2而导致的一些毒副作用。2017年Novartis团队首次报道了EED抑制剂(EED226)抑制肿瘤的效果5,15。利用PRC2复合物和H3[21-44, K27Me0]通过HTS方式筛选到先导化合物,通过结构解析发现该化合物的结合会进一步诱导EED的构象变化,并产生更容易靶向的活性口袋(PDB ID: 5GSA)4,14。直到后来发现活性更好的compound 43(EED226),并且在CDX模型中表现出良好的效果,给药停止后的百余天,肿瘤也未曾复发。结合DMPK实验在溶解度、透膜性、稳定性、吸收、生物利用度等方面的评价,都展示较好的成药性,在选择性和安全性的评价中,都表现了良好的特征,也表面靶向EED的可能性及优势。
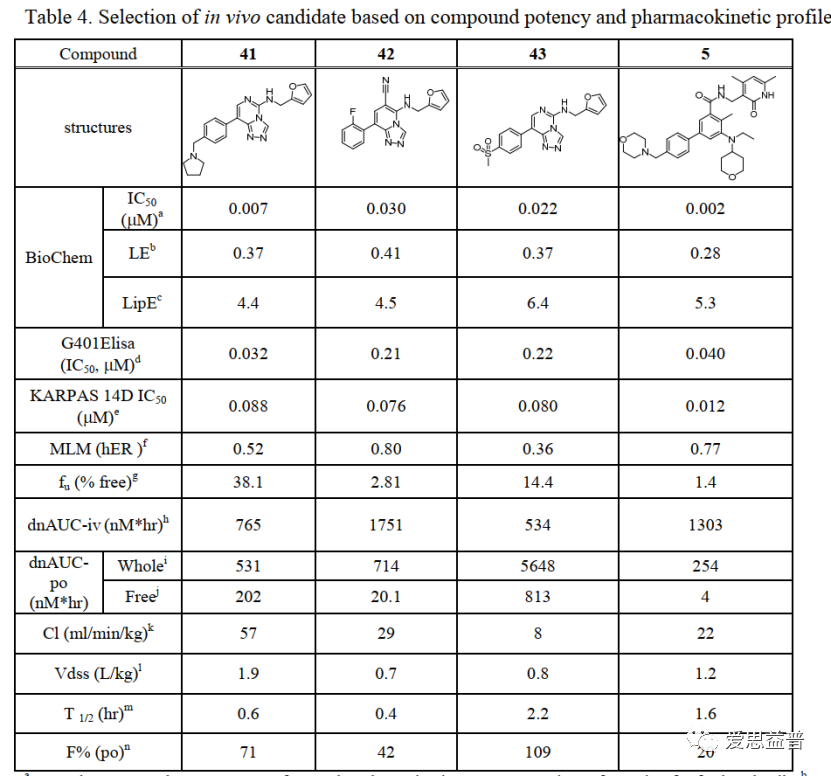
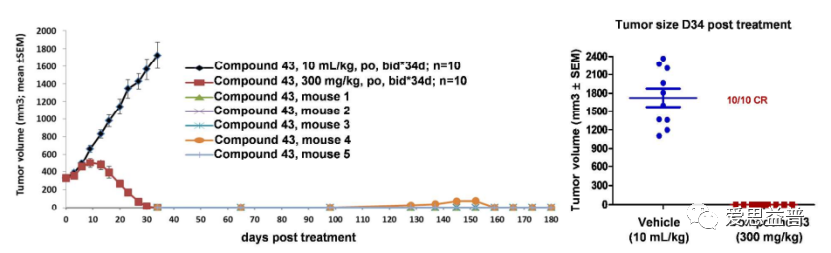
除此之外,还有一些EED的抑制剂陆续被报道,如A-39516(化合物综合特性不好,文中用到了很多常用的筛选方法),MAK68317,BR00118,EEDi-5285和EEDi-105619,体外CDX模型上也展现了长效的抑瘤作用
地 址: 北京市经济技术开发区科创十三街18号院16号楼
联系人: 蔡世伟
电 话: 010-67809840,18513687260
传 真: 010-67809840
Email:caisw@ice-biosci.com


 EZH2 status in various cancers3
EZH2 status in various cancers3 Possible architecture of the PRC2 complex2
Possible architecture of the PRC2 complex2