心房颤动是临床上最常见的持续性心律失常,人群发病率约2%,65岁以上人群>5%。房颤的发生常与心脏疾病有关,但是有30%不伴心脏疾病。Framinghan1等人进行了系统性研究,发现心房颤动增加了的死亡率,尤其是增加了中风的发病率。结构和功能持续变化在内的心房重构 (atrial remodeling)2被认为在房颤的发生中扮演了重要的角色。
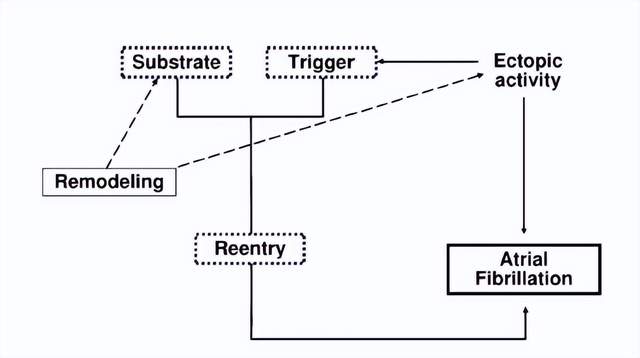
(General schema representing AF mechanisms and the role of remodeling2)
1. 心房重构和折返
在心房肌细胞中, 一系列功能以及结构上持久性的改变,被定义为心房重构(atrial remodeling)。心房重构往往会促进一种非生理性的现象:折返。 折返(reentry)指的是是由于心肌兴奋性或电活动的不均匀或存在额外的离子通道激活(例如:EAD,DAD),造成异常的自主兴奋性,逆原方向折回此前激动过的心肌,使其再次除极的电生理现象。折返会扰乱心脏正常的来自于窦房结的搏动节律(窦性节律)。心房重构和折返,都是能够导致房颤(Atrial Fibrillation)发生的生理学基础。
下文,我们会试着从一些基础的概念入手,来聊聊心房重构和异常的心肌活动。
心房重构和异位搏动
心脏正常的搏动,收到来自于窦房结的搏动节律(窦性节律)的控制。生理状态下,尽管心房肌细胞动作电位4期(phase 4)可能产生自主兴奋(automatic atrial foci),但是这样的自主节律比窦性节律低,因而不会导致异位心律。在房性心动过速以及充血性心力衰竭相关的重构中,心房肌细胞中都会有检测到起搏电流(If);胞内钙离子过载诱发的迟发性后除极(DAD)以及动作电位延长诱发的早发性后除极(EAD)这样的触发事件。无论何种类型的后除极事件,只要达到动作电位阈值,都会产生异位搏动(Ectopic Activity)。2000年,Chen等发现肺静脉心肌组织具有自律性。现在一般认为,这些具有自律性的细胞产生房早,然后引发房颤2
心房重构和折返
不应期(refractory period)是一个比较重要的概念,心肌组织发生动作电位之后的一段时间内,由于钠离子通道处于失活状态,这部分完全地或部分地丧失兴奋性的特性。 心房肌组织不应期取决于动作电位的时程(action potential duration)。
在心房重构中,不应期缩短,传导速度减缓以及心房扩张都会促使房颤发生。
不应期缩短:心肌细胞动作电位的时程是动作电位平台期内电流和外向电流平衡作用的结果。前者主要是钙离子通道介导的内向电流,这种内向电流使得细胞膜处于去极化水平(钠通道失活而不可再兴奋);后者主要是介导外向电流的钾通道,外向电流使得细胞膜恢复到极化的水平(钠通道恢复到可激活的状态)。在心房重构中,可以检测到钙通道活性的降低以及钾通道活性增加3。离子通道这种变化,会使得动作电位和不应期时程缩短,使得心房细胞更容易被再次激活。到遭遇到异常激动作用,产生折返现象。
心房传导速度减缓4:细胞膜钠离子通变,缝隙连接(connexins)以及心肌组织的结构改变都会导致心房传导速度减缓。 在房性心动过速重构(atrial tachycardia remodeling -ATR)中,钠通道活性降低直接减弱了传导的驱动力(energy for conduction);同时心房肌细胞长径向(longitudinal)的低电阻间隙连接蛋白connexin-40表达量降低以及心房肌组织的纤维化(fibrosis)。 这些变化都减缓兴奋在心房肌组织中的传导速度,给处于不应期的组织留出重新兴奋的时间窗口,而导致异常兴奋,产生折返现象。
心房扩张:心房过速以及充血性心力衰竭相关的重构都会导致心房扩张(atrial dilation),这就会产生了更多的适应折返回路(reentry circuits)的心房组织。
2. 心房重构的分子机制
心房复极异常
认识到房颤能改变心房电生理特性,促进房颤的诱导和维持 (AF beget AF),是房颤病理生理学的一个重要进展5。房性心动过速重构 (ATR),通过影响多个离子通道的活性,导致动作电位时程的缩短,缩短心房的不应期,从而促进折返性房颤的发生。
房性心动过速, 会导致胞内钙离子超载, 这是一种具有细胞毒性的现象;出现钙超载后,细胞自身会启动的保护措施,如:加速钙离子通道失活基因和蛋白质表达变化,降低钙通道数量。钙电流降低减缓了心肌细胞的钙负荷,同时缩短不应期,促发了更小、更多的心房折返回路,使得房颤持续化。房性心动过速还会增加内向整流电流,如IK1和IKACh,从而进一步缩短动作电位,并促使房颤的发生和持续。

(Mechanisms underlying ATR2)
心房传导异常
大量证据表明,结构重构尤其是间质纤维化,是房颤基质(AF subtract)形成的重要诱因。纤维化是一种结构性重构(structural remodeling)。组织纤维化干扰了心肌细胞连续的规律的缆线状排列来干扰局部心房传导,导致心房组织传导速度地减慢。 血管紧张素II和TGF-β1是成熟的促纤维化分子最近的证据表明,血小板源性白血病具有重要作用生长因子(PDGF)和结缔组织生长因子(CTGF),都能促进组织纤维化。
另外,也有部分研究提示了,心房组织中的间隙连接以及钠离子通道,在心房传导异常过程中,都会表现在出一定的重构的现象。关于离子通道在心房传导异常的作用还需要进一步的研究2,6,7
异位搏动形成
细胞内钙离子平衡的紊乱,是形成诱发房颤的异位节律点的主要机制. 在生理状态下的心肌细胞中, 钙离子通过位于细胞膜上的L型钙离子通道,进入细胞。流入的钙离子会激活位于内质网Ryanodine受体,进而从内质网中释放大量的钙离子,引起心肌细胞收缩。随后细胞内钙离子由内质网钙泵和钠钙交换体(NCX),摄取进入内质网以及排出到细胞外。
Ryanodine receptors过度磷酸化往往会导致心肌细胞舒张期内质网钙离子泄露,升高胞内钙离子浓度,并进而诱发NCX的功能增强。NCX在工作中,在排出一个钙离子的同时,会带入三个钠离子进入细胞,因而产生去极化电流。这种额外的兴奋性,可能导致延迟后除极(DAD)。另外,位于内质网上的另一类受体IP3受体蛋白表达在房颤中显著升高,也加剧了内质网钙离子泄露。这些都也被认为是主要的房颤相关的异位活性(AF-related ectopic activity)的机制。很多关键的调节细胞内钙离子浓度蛋白的磷酸化水平,在房颤中的变化也会进一步产生致心律失常性的效应2。
3. 结论:
在了解心房重构的机制方面已经取得了相当大的进展。这些见解对我们理解房颤的病理生理学和开发新的治疗方法具有潜在的重要意义
附录:在爱思益普,我们构建涵盖离子通道靶点、原代心肌细胞、兔子浦肯野,;离体心脏Langendorff检测平台以及多种ex vivo 和in vivo的心脏疾病模型。可以为客户提供高品质的服务。
技术平台展示
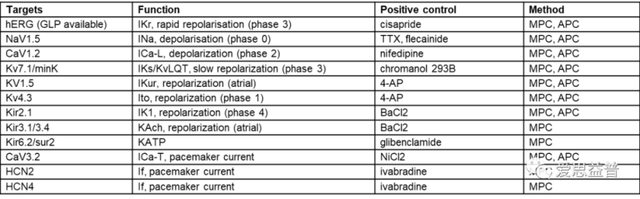
A.离子通道稳定细胞系和原代心肌细胞检测系统
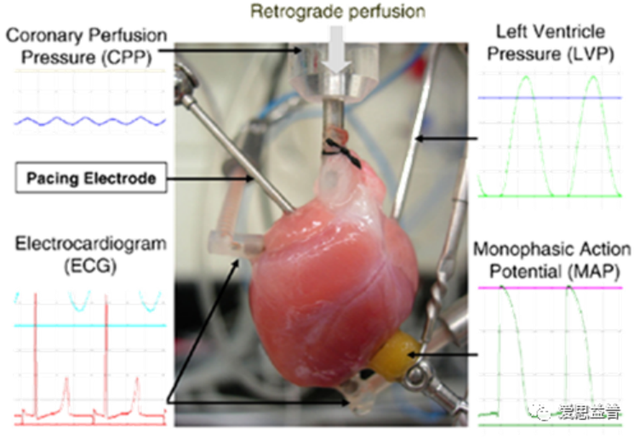
B.Langendorff 离体心脏灌流(小鼠,大鼠,豚鼠以及兔子)
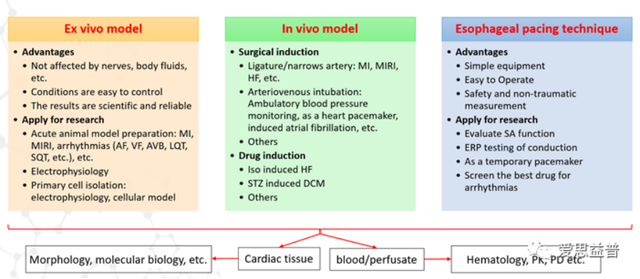
C.体内体外模型
Ref
1. Benjamin EJ, Wolf PA, D'Agostino RB, Silbershatz H, Kannel WB, Levy D. Impact of atrial fibrillation on the risk of death: the Framingham Heart Study. Circulation. 1998 Sep 8;98(10):946-52. doi: 10.1161/01.cir.98.10.946. PMID: 9737513.
2. Nattel S, Burstein B, Dobrev D. Atrial remodeling and atrial fibrillation: mechanisms and implications. Circ Arrhythm Electrophysiol. 2008 Apr;1(1):62-73.
3. Nattel S, Maguy A, Le Bouter S, Yeh YH. Arrhythmogenic ion-channel remodeling in the heart: heart failure, myocardial infarction, and atrial fibrillation. Physiol Rev. 2007; 87:425– 456.
4. van der Velden HM, Ausma J, Rook MB, Hellemons AJ, van Veen TA, Allessie MA, Jongsma HJ. Gap junctional remodeling in relation to stabilization of atrial fibrillation in the goat. Cardiovasc Res. 2000;46: 476–486.
5. Wijffels MC, Kirchhof CJ, Dorland R, Allessie MA. Atrial fibrillation begets atrial fibrillation: a study in awake chronically instrumented goats. Circulation. 1995; 92:1954 –1968.
6. Wetzel U, Boldt A, Lauschke J, Weigl J, Schirdewahn P, Dorszewski A, Doll N, Hindricks G, Dhein S, Kottkamp H. Expression of connexins 40 and 43 in human left atrium in atrial fibrillation of different aetiologies. Heart. 2005; 91:166 –170.
7. Firouzi M, Ramanna H, Kok B, Jongsma HJ, Koeleman BP, Doevendans PA, Groenewegen WA, Hauer RN. Association of human connexin40 gene polymorphisms with atrial vulnerability as a risk factor for idiopathic atrial fibrillation. Circ Res. 2004;95:e29–e33.
8. Zima AV, Blatter LA. Inositol-1,4,5-trisphosphate-dependent calcium signaling in cat atrial excitation-contraction coupling and arrhythmias. J Physiol. 2004; 555:607– 615.
关于爱思益普
北京爱思益普生物科技股份有限公司2010 年成立,专注于从先导化合物筛选,优化到临床前候选分子阶段基于细胞和生化的药物体外筛选技术和早期药物机理研究,关注肿瘤,免疫,心血管,中枢神经系统等疾病领域的生物学和药理学研究技术,打造创新型CRO+的探索者。爱思益普关注新药研发企业对速度、效率和结果的需求,用专业的技术和高效的沟通帮助客户提高新药研发的效率。
爱思益普致力于建立全面的靶点筛选和体外生物学研究平台,建立一系列基于生物学和药理学的研究技术集群,为客户提供涵盖各种靶标和疾病领域的新药研发服务,包括从活性化合物发现,靶标验证,先导化合物优化到临床前候选药物的选择。公司建立了100+离子通道,100+GPCR,800+酶学靶点以及40+核受体筛选细胞系及验证方法,涵盖了大部分成药性靶点,在国内具有**水平和竞争优势。公司建立了蛋白纯化,生化酶学,肿瘤细胞学,免疫学,电生理学,心脏体外研究,中枢神经系统药理学,药物脱靶效应筛选,药物心脏安全性评价,ADME等平台,全面支持创新药研发的DMTA(设计,合成,测试,分析)一体化服务。爱思益普为国内新药研发机构超过600家以上机构提供服务,得到客户广泛好评。
爱思益普目前拥有7000平方米实验室,200多名员工,仪器设备投入超过5000万元,2人入选北京市“海聚工程”海外高层次人才及北京市特聘专家。是国家高新技术企业,中关村高新技术企业。2021年服务全国创新药研发生物科技企业超过300家,每年数十个项目进行新药临床研究(IND)申报,多个项目通过NMPA的现场核查。
