一、血管结构
血管是指血液流过的一系列管道。血管内皮是血流和血管壁之间的界面。除角膜、毛发、指(趾)甲、牙质及上皮等地方外,血管遍布人体全身。血管从管腔面向外依次为内膜、中膜和外膜。按构造功能不同,血管分为动脉血管、静脉血管和毛细血管三种。
动脉起自心脏,不断分支,口径渐细,管壁渐薄,最后分成大量的毛细血管,分布到全身各组织和细胞间。毛细血管再汇合,逐级形成静脉,最后返回心脏。动脉从心脏将血液带至身体组织,静脉将血液自组织间带回心脏,微血管(按血管分支的顺序,微血管主要包括微动脉、毛细血管和微静脉)则连接动脉与静脉,是血液与组织间物质交换的主要场所。动脉与静脉通过心脏连通,全身血管构成封闭式管道。人体内血管分布常具有对称性,并与机能相适应,大的血管走向多与身体长轴平行,并与神经一起被结缔组织膜包裹成血管神经束。
二、血管内皮细胞研究方向及研究方法
血管内皮细胞功能
人体血管内皮细胞覆盖于血管内膜表面,是一种单层扁平上皮细胞。血管内皮细胞是作为血管壁与血液之间的天然屏障。完整的血管内皮细胞为血液中的凝血因子、抗凝因子以及血小板之间的相互作用提供了光滑的表面,同时参与凝血、抗凝及纤溶(纤维蛋白溶解)系统,便于维持凝血和抗凝之间的平衡状态,保证血液在血管内正常流动。内皮细胞合成和释放许多局部调节通透性、血管张力、平滑肌细胞生长和迁移、炎症反应和血小板功能的因子。组织损伤时白细胞从血液中通过血管内皮迁移到组织中去。在急性炎症情况下,中性粒细胞粘附到内皮细胞上,白细胞先迁移后渗出,然后向血管外迁移。血管内皮细胞还具有促进先天性和后天性免疫系统与血管壁相互作用的功能。
内皮细胞功能性障碍疾病
内皮细胞和血管系统的改变在人类最可怕的疾病的发病机制中起着中心作用,因为内皮细胞具有维护毛细血管通畅和功能的关键作用。内皮细胞直接参与外周血管疾病、中风、心脏病、糖尿病、胰岛素抵抗、慢性肾衰竭、肿瘤生长及转移、静脉血栓形成以及严重的病毒感染性疾病。内皮细胞的功能性障碍是动脉粥样硬化的先兆,也会导致动脉血栓的形成。
健康内皮(A)和功能失调内皮(B)。健康的内皮显示血管舒张表型,包含高水平的血管舒张剂,如一氧化氮(NO)和前列环素(PGI2),以及低水平的活性氧(ROS)和尿酸。健康的内皮还具有由低水平的纤溶酶原激活剂抑制剂1(PAI-1)、血管性血友病因子(vWF)和P-选择素(又名CD62P)组成的抗凝表型。可溶性血管细胞粘附分子(sVCAM)、可溶性细胞间粘附分子(sICAM)、E-选择素(CD62E)、C-反应蛋白(CRP)、肿瘤坏死因子α(TNF-α)和白细胞介素-6(IL-6)的低水平表明可能存在很少的炎症。最后,内皮祖细胞(EPCs,表明血管修复能力)的数量很高;而内皮微颗粒(EMPs)和循环内皮细胞(CECs)的水平很低,表明内皮压力/损伤。在内皮功能失调的情况下,其表型特征包括血管扩张受损,氧化应激、尿酸、过氧化脂质自由基、**酪氨酸和一氧化二氮增加,以及促凝血和促炎症表型,血管修复能力下降,EMPs和CECs数量增加。
工具病毒在血管内皮中的应用
案例一:利用AAV载体在视网膜血管内皮进行基因编辑
作者利用腺相关病毒(AAV:1E+12 vg/mL,1μL)将CRISPR-Cas9导入血管内皮细胞,开发了有效的体内基因组编辑方法。在该系统中,SpCas9的表达由特异性内皮启动子细胞间粘附分子2(pICAM2)驱动,以限制只在血管内皮细胞中表达这种外源酶,AAV1可有效感染血管内皮细胞。通过在氧诱导视网膜病变(OIR)的小鼠模型中编辑视网膜血管内皮细胞中的VEGFR2(血管内皮细胞生长因子受体2)来举例说明这种方法,并期望该简化方案可以扩展到其他体内编辑内皮细胞基因组的研究中。
AAV载体在血管内皮细胞中基因治疗的应用
案例二:利用脑血管内皮细胞AAV特异性载体治疗新生小鼠色素失调症
通过静脉注射AAV-BR1(展示NRGTEWD肽的AAV2,具有良好的靶向特异性,在脑中转基因表达很强,在非靶向器官中表达很少或没有表达)-CAG-Nemo(6E+10 gp/每只,genomic particles/gp/基因组颗粒)使新生色素失调小鼠(Nemo-/+)的内皮细胞存活和血脑屏障通透性正常化。
案例三:利用双杂合AAV载体内皮靶向表达血管性血友病因子(vWF)
血管性血友病是临床上常见的一种遗传性出血性疾病,其发病机制是患者的血管性血友病因子(von Willebrand factor,vWF)基因突变,导致血浆vWF数量减少或质量异常。对vWF缺陷型(vWD)小鼠静脉注射内皮特异性ICAM2(细胞间粘附分子2)-vWF或肝特异性hAAT(Human αl -antitrypsin promoter,人抗胰蛋白酶α1启动子)-vWF双杂交载体,注射剂量5E+11 vg/每只(血清型为AAV9mut,通过设计编码每个七肽的重叠寡核苷酸而产生),成功表达了vWF基因。
图1. 表达vWF的双杂合AAV载体构建
图2. 内皮或肝脏特异性双杂交AAV载体诱导的vWD(血管性血友病)小鼠vWF的表达
三、AAV感染血管内皮的血清型
研究显示,不同血清型的AAV通过与特定受体结合,具有一定的组织趋向性。基于AAV血清型2(AAV2)的载体表现出广泛的组织和细胞亲和性,但AAV2载体不能有效地转导血管内皮细胞,这是由于硫酸乙酰肝素蛋白多糖(Heparan sulphate proteoglycans,HSPG)将AAV-2隔离在细胞外基质中,从而阻止细胞进入和对蛋白酶体的敏感性。通过将从噬菌体线性展示中分离的七聚体肽SIGYPLP整合到AAV 2血清型衣壳的I-587位,设计了一个靶向血管内皮的rAAV载体(AAVsig)。
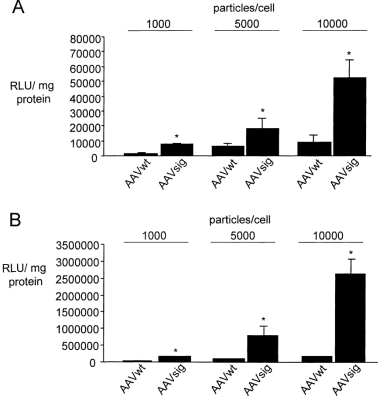
图3. AAVsig介导增强的内皮细胞基因转移。不同剂量的AAVwt和AAVsig感染不同内皮细胞(A:人脐静脉内皮细胞(HUVEC);B:人隐静脉内皮细胞(HSVEC))以及β-半乳糖苷酶表达分析。
如图所示,与传统2型相比,AAVsig对脐静脉内皮表达增加约5.9倍,对隐静脉内皮细胞增加约28.2倍。
有研究通过在AAV 2血清型衣壳的I-587位插入不同的七聚肽重新筛选靶向血管内皮的AAV突变体,结果显示AAV-VSSSTPR(AAV-VEC)和AAV-NNPLPQR(AAV-NEC)两种病毒变体具有很强的选择性,但AAV-VEC的转导效率最高,是AAV2的2.7倍。更重要的是在GOI(Gene of Interest,简称GOI)为10000时,AAV-VEC的转导效率是AAVsig的13倍。
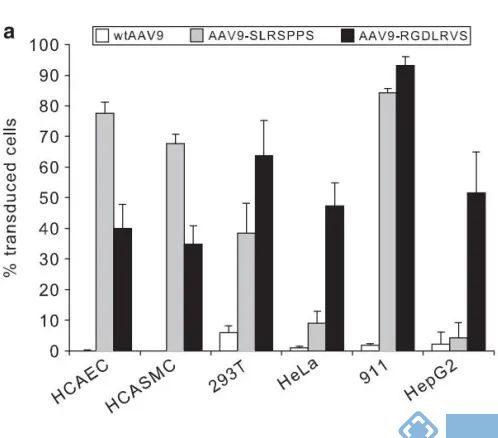
另有研究显示,通过类似的方法在AAV9衣壳位点A589插入两种七肽RGDLRVS和SLRSPPS,以流式筛选荧光确认感染效率,并论证两者对内皮细胞感染情况。
数据显示,在人冠状动脉内皮细胞(HCAEC);人冠状动脉平滑肌细胞(HCASMC);肝肾等来源的永生化细胞(HEK293T,HeLa,911,HepG2)中rAAV9插入肽有效地提升了对内皮细胞的感染效率(SLRSPPS更优),但不具有内皮细胞靶向性。
有研究通过对AAV9血清型进行一系列改造,开发了一种新血清型AAV-BI30。AAV-BI30这种新血清型能够特异且高效地转导整个中枢神经系统(CNS)的内皮细胞。在小鼠、大鼠模型和体外人类微血管内皮细胞中均能稳定表达。
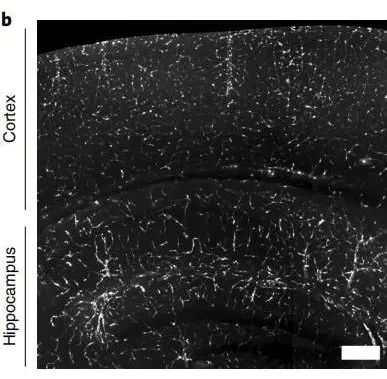
在C57BL/6小鼠静脉注射AAV-BI30(AAV-BI30-CAG-NLS-GFP-WPRE载体,1.00E+11 vg/每只),10d后皮层和海马中可见明显的内皮细胞标记,而较少转导外周器官微血管系统中的内皮细胞。
图4. AAV-BI30标记小鼠皮层和海马内皮细胞
在相同的注射条件下,AAV-BI30标记的小鼠脑内皮细胞数量明显多于AAV-BR1。同时,AAV-BI30的表达在整个大脑中没有明显的区域间差异,即皮质、海马、丘脑和小脑均表现出>80%的内皮细胞转导。此外,与AAV-BR1不同的是,AAV-BI30具有高度内皮细胞特异性,标记神经元或星胶细胞的情况罕见。
图5. AAV-BI30与AAV-BR1标记情况的差异
四、AAV感染血管内皮途径及剂量
AAV感染血管内皮的方式主要有玻璃体腔注射、动脉注射、静脉注射以及肌肉注射。有研究人员通过静脉注射、肌肉注射、腹腔注射以及皮下注射对AAV感染效率进行评估,发现静脉注射后AAV的感染效率最高。
五、血管内皮细胞疾病中常用的小鼠品系
血管内皮细胞疾病动物模型:
色素失调症、血管性血友病、动脉粥样硬化、氧诱导视网膜病变。
六、参考文献
1.Wu W, Yang Y, Yao F, et al. AAV-mediated in vivo genome editing in vascular endothelial cells. Methods. 2021 Oct;194:12-17.
2.Körbelin J, Dogbevia G, Michelfelder S, et al. A brain microvasculature endothelial cell-specific viral vector with the potential to treat neurovascular and neurological diseases. EMBO Mol Med. 2016 Jun 1;8(6):609-25.
3.Barbon E, Kawecki C, Marmier S, et al. Development of a dual hybrid AAV vector for endothelial-targeted expression of von Willebrand factor. Gene Ther. 2021 Jan 17.
4.Nicklin SA, Buening H, Dishart KL, et al. Efficient and selective AAV2-mediated gene transfer directed to human vascular endothelial cells. Mol Ther. 2001 Sep;4(3):174-81.
5.Zhang L, Rossi A, Lange L, et al. Capsid Engineering Overcomes Barriers Toward Adeno-Associated Virus Vector-Mediated Transduction of Endothelial Cells. Hum Gene Ther. 2019 Oct;30(10):1284-1296.
6.Varadi K, Michelfelder S, Korff T, et al. Novel random peptide libraries displayed on AAV serotype 9 for selection of endothelial cell-directed gene transfer vectors. Gene Ther. 2012 Aug;19(8):800-9.
7.Krolak T, Chan KY, Kaplan L, et al. A High-Efficiency AAV for Endothelial Cell Transduction Throughout the Central Nervous System. Nat Cardiovasc Res. 2022 Apr;1(4):389-400.
如有相关实验需求,请咨询我们!
我司重磅推出环路示踪,光遗传,钙记录,膜片钳,电生理等动物实验服务!
公司相关业务:
神经环路示踪病毒载体、基因编辑(敲入、敲除、点突变、敲低)、基因过表达/干扰服务、行为学小鼠模型构建、干细胞诱导分化、整包服务等。